حقایق جالب درمورد آب سخت!

آب سخت چیست؟
آب سخت آبی است که حاوی مقادیر زیادی از مواد معدنی از قبیل منیزیم و کلسیم است.سرکیب، از بین برد. همانطور که در معادله زیر نشان داده شده است:
Ca(HCO3)2 →← CaCO3 + CO2 + H2O
سختی دائمی ناشی از نیترات کلسیم و منیزیم، سولفاتها و کلریدها و غیره است. با جوشیدن این نوع سختی از بین نمیرود.
توصیف علم دربارهی آب سخت چیست؟
به طور علمی سختی آب یعنی وجود یونهای محلول از قبیل کلسیم(++Ca) و منیزیم (++Mg) در آب؛ که از طریق تماس آب با سنگها و رسوبات محیط حاصل میشود. بار مثبت این یونها با حضور آنیونها (یونهای منفی) خنثی میشود ؛ که از مهمترین این آنیونها، بی کربنات –HCO3 و کربنات—CO3 هستند. منشاء این یونها در رسوبات آهکی و دی اکسید کربنی است که در تمام آبهای در معرض جو و آبهای زیرزمینی وجود دارد.غلظت بالای یون هیچ خطری برای سلامتی ایجاد نمیکند، اما میتوانند در واکنشهایی که باعث تشکیل رسوبات معدنی غیر قابل نفوذ میشود، مشکل ایجاد کند. رسوبات حاصل از آب سخت میتواند برای بسیاری از مصارف مانند لباسشویی، ماشین ظرفشویی و فرآیندهای تجاری-صنعتی مشکل ایجاد کند. همچنین بقایایی از خود به شکل رسوب بر جای میگذارد؛ مخصوصا روی وسایلی از قبیل شیر آب و سر دوش حموم؛ که از بین بردن آن نیز بسیار سخت است.
اغلب تعاریف زیادی را به آب سخت نسبت میدهند. درواقع همهی این توصیفات بر اساس یک مؤلفه هستند؛ اینکه آب سخت با حل شدن ترکیبات یونی در آن ایجاد میشود.یونها چگونه وارد آب میشوند؟!
تعاریف زیر به شما کمک میکند که چگونگی ورود یونها به داخل آب و تشکیل آب سخت را بهتر متوجه شوید.A. تفکیک یونی فرآیندی است که در آن ترکیبات یونی به یونهای کوچکتر تجزیه میشود.
B. انحلال فرآیندی است که در آن کریستالهای یونی به یونهای در آب تبدیل میشوند.
C. آبپوشی فرآیندی است که در آن یونها توسط مولکولهای آب احاطه میشوند.
D. محلول یونی محلولی است که وقتی موادی در آب حل میشوند، تحت تاثیر تغییرات فیزیکی و شیمیایی به صورت یونهای محلول در میآیند.
E. الکترولیتها دسته مهمی از ترکیبات هستند که هنگام حل شدن، یونها را در محلول آزاد میکنند. موادی که هنگام محلول شدن از خود یونی آزاد نمیکنند غیرالکترولیت مینامند. اگر کل فرآیند فیزیکی و شیمیایی که یونها تشکیل میدهند کاملا و بصورت ۱۰۰٪ کارآمد باشد( یعنی اگر تمام محلول حاوی یونهای آزاد شده باشد)، دراین صورت آن مواد به عنوان یک الکترولیت قوی شناخته میشود. اگر تنها بخشی از مواد حل شده تحت فرآیند یونی قرار گیرد، دراین صورت به آن الکترولیت قوی میگویند. با اندازه گیری مقدار رسانایی الکتریکی یک محلول آبی حاوی مواد حل شده در آن، میتوان قوی یا ضعیف بودن الکترولیت و یا غیر الکترولیتی بودن آن را تشخیص داد. برای هدایت الکتریسیته، یک ماده باید حاوی ذرهای تغییرپذیر با بار الکتریکی باشد. سیمهای فلزی از معروف ترین رساناهای الکتریکی هستند که حاوی ذراتی تغییرپذیر با بارالکتریکی هستند. این ذرات را الکترون مینامند. محلولها اگر حاوی مقادیری از یونها باشند میتوانند یک رسانای الکتریکی باشند. افزایش رسانایی الکتریکی با افزایش مقدار یونهای موجود در محلول رابطه ی مستقیم دارد.
آب و سایر ملکولهای قطبی جذب یونها میشوند. به جذب الکترواستاتیکی بین یک یون با یک مولکول قطبی، جاذبه ی یونی-قطبی گفته میشود.این جاذبهها نقش مهمی در انحلال ترکیبات یونی در آب دارند. وقتی ترکیبات یونی در آب حل شوند، یونها به طور یکنواخت در کل محلول پراکنده میشوند زیرا مولکولهای آب یونها را احاطه کرده و باعث کاهش نیروهای الکترواستاتیکی قوی بین آنها میشود.این فرآیند نشان دهنده یک تغییر فیزیکی است که به عنوان تفکیک یونی شناخته میشود.
در برخی موارد، جاذبه ی الکترواستاتیکی بین یونهای یک بلور انقدر زیاد است، یا نیروی جذب کنندهی یونی-قطبی بین مولکولهای آب و یونها انقدر ضعیف هستند که این افزایش اختلال نمیتواند انرژی مورد نیاز برای جداسازی یونها را جبران کند و بلورها به صورت انحلال ناپذیر در میآیند.
این مورد در مورد ترکیباتی مانند کربنات کلسیم (سنگ آهک)، فسفات کلسیم (جزء معدنی استخوان) و اکسید آهن (زنگ زدگی) صدق میکند. الکترولیتها یکی از اصلی ترین دلایل سالم بودن آب سخت برای شماست. علم ثابت کرده است که الکترولیتها نقش مهمی در سلامتی ما دارند.
اگر الکترولیتی به بدن خود نرسانید این اثرات در شما پدیدار میشوند:
ضربان قلب نامنظم
ضربان قلب سریع
خستگی
بی حالی
تشنج
حالت تهوع
استفراغ
اسهال یا یبوست
گرفتگی شکم
گرفتگی عضلات
ضعف عضلانی
تحریک پذیری
گیجی
سردردها
بی حسی و گزگز
همچنین الکترولیتها مواد معدنی هستند که هنگام حل شدن در آب، بار الکتریکی دارند.
میزان سختی آب چگونه سنجیده میشود؟!
از آنجایی که یونها در آب و همچنین آب سخت شکل میگیرند، پس میتوان سختی آب را اندازه گیری کرد.
براساس USGS، سختی آب بر اساس غلظت کلسیم و منیزیم محلول در ppm (قطعات در میلیون)، میلی گرم در لیتر (میلی گرم در لیتر)، یا GPG (دانه در هر گالن) تعیین میشود [17.1 ppm / mg / L = 1 gpg]
آب نرم – 0 تا 60 میلی گرم در لیتر (میلی گرم در لیتر)
آب نسبتاً سخت – 61 تا 120 میلی گرم در لیتر (میلی گرم در لیتر)
آب سخت – 121 تا 180 میلی گرم در لیتر (میلی گرم در لیتر)
آب بسیار سخت – بیش از 180 میلی گرم در لیتر (میلی گرم در لیتر)
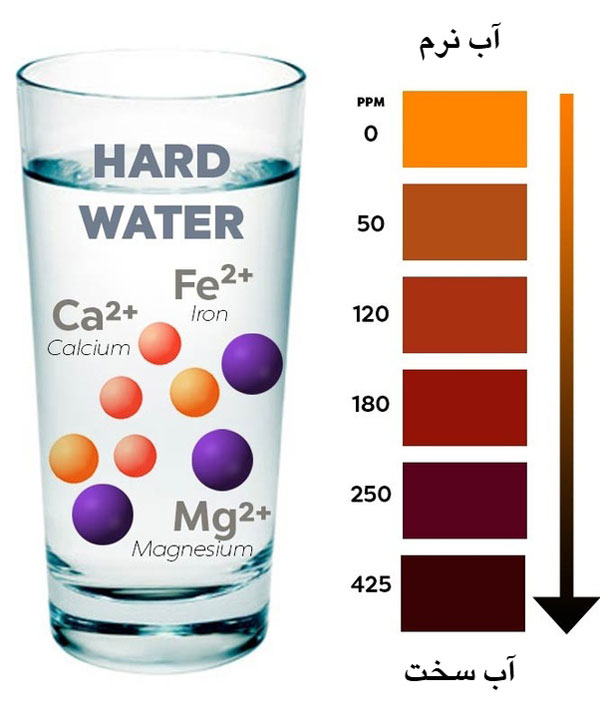
برای غلظت خاص آب سخت، میتوانید به www.hydroflow-usa.com/water-hardness-map مراجعه کنید.
رابطه ی آب سخت و رسوب کربنات کلسیم!
نکته مهم بعدی برای درک بهتر آب سخت، رسوب گذاری و نحوه وقوع آن است.
در علم شیمی، رسوب مادهای جامد و نامحلول است که از یک محلول مایع پدیدار میشود. هنگامی که محلول فوق سیر شده باشد، حاوی مواد حل شدهی بیشتری در مقایسه با شرایط عادی همان محلول است.
هنگامی که یک عامل رسوب دهنده ظاهر شود، این امر موجب میشود که واکنش شیمیایی لازم برای ترکیبات انحلال ناپذیر پدید آید. متداول ترین عامل رسوب گذاری CO2 است که این عامل خود در میزان رسوب گذاری کربنات کلسیم در آب نقش بسزایی دارد، که این علت اصلی رسوبات و مشکلات آب سخت است.
آب سخت در کجا شکل میگیرد؟
آب سخت در اعماق زمین در محفظههای آبی بزرگ قرار داد که به سفرههای آب زیرزمینی معروف هستند. برخی از این سفرههای آب احاطه شده با سنگ آهک و سایر ذخایر معدنی هستند. با توجه به مقادیر بالای CO2 محلول در آب (اسید کربن)،که این امر باعث کاهش pH آب و اسیدی شدن آن میشود.
هنگامی که میزان pH آب به زیر 7.6 برسد، آب کم کم منیزیم و سنگ آهک را در خود حل میکند و به این ترتیب یونهای کلسیم و منیزیم در آب آزاد میشوند. به این ترتیب آب سخت تشکیل میشود. از آنجایی که دی اکسید کربن در محیط فراوان در آب بصورت منحل است (که اسید کربونیک راایجاد میکند ) و با توجه به حضور یونهای کلسیم و منیزیم، همه موارد مورد نیاز برای اعمال رسوب کربنات کلسیم فراهم است. برای اینکه این اتفاق رخ دهد، فقط باید نقطه اشباع آب توسط PH، دما و یا فشار تغییر یابد.
رابطه ی بین رسوبات سفید صابونی و آب سخت چیست!

این دو چیز یکی نیستند اما رابطهای بین آنها بر قرار است.
حل شدن صابون با آب سخت یک ماده ی جامد سفید رنگی تولید میکند که به رسوب صابونی معروف است. آب سخت باعث کاهش کف کردن صابون نیز میشود.
این مواد نباید با رسوبات کربنات کلسیم اشتباه گرفته شود( که از آب سخت هنگام تغییر دما، pH یا فشار حاصل میشود). دلیل ایجاد رسوب صابونی این است که یونهای دارای 2بار مثبت با تشکیل یک رسوب جامد، خاصیت سورفاکتانت (مواد فعال در سطح ) صابون را از بین میبرند.
این سختی را بیشتر میتوان به عنوان یک خصوصیت منحصربفرد آب قلمداد کرد، که کف کردن صابون را نیز کاهش میدهد.
نقش چرخهی کلسیم و بی کربنات در تولید آب سخت
بیایید چرخه ی کلسیم را برای درک بهتر جریان تولید آب سخت مرور کنیم.
چرخه کلسیم در واقع انتقال کلسیم بین دو فاز محلول و جامد است. این امر بطور مستمر تامین یونهای کلسیم از سنگها، ارگانیسمها و خاکها را تضمین میکند.
چرخه ی کلسیم وقتی شروع میشود که ابتدا آب با دی اکسید کربن موجود در هوا واکنش نشان دهد و اسیدکربنیک تولید شود. اسید کربنیک موجود در آب باران با کلسیم کربنات در ساختارهای سنگی شکل مانند سنگ آهک، دولومیت، گچ و سایر سنگهای حاویاین مواد واکنش نشان میدهد و بی کربنات کلسیم (کربنات هیدروژن کلسیم) را تشکیل میدهد. بی کربنات کلسیم از طریق رواناب به اقیانوس منتقل میشود. بسیاری از یونهای کلسیم اقیانوس توسط ارگانیسمها برای تشکیل پوستههاو ساختارهای اسکلتی بی کربناتی مصرف میشود.
وقتی این ارگانیسمها از بین میروند، بصورت لایهای در بستر اقیانوس تهنشین میشوند. با گذشت زمان، به دلیل حرکات زمین شناسی و فشار وارده، این لایهها سنگ آهک و ساختارهای سنگی شکل غنی از کلسیم را تشکیل میدهند و بدین ترتیب چرخه کلسیم تکمیل میشود.
تشکیل آب سخت در محیط به همان گونه که در طبیعت ساخته میشود :
این دستور العمل نزدیک به چیزی است که در طبیعت مییابید. دو نکته مهم که هنگام تشکیل آب سخت باید به آنها توجه کنید:
+ ابتدا از آب مقطر استفاده كنید که برای پذیرش یونها قبل تشکیل محلول سیر شده، بیشترین فضای ممکن برای جای دادن یونها را داشته باشند.
+ دوم، مهم است که آب را خیلی سرد نگه دارید زیرا با بالا رفتن دمای آب، میزان حلالیت کلسیم کاهش مییابد.
سعی کردیم در این پست شما را با آب سخت آشنا کنیم. نحوه تشکیل آب سخت هم از مواردی بود که به بررسی آن پرداختیم. آب سخت به مرور در سیستمهای لولهکشی باعث ایجاد رسوب سخت میشود که به مرور به سیستم لوله کشی داخلی و لوازم موجود در منزلتان که با آب سر و کار دارند آسیب خواهد رساند. گاهی هزینههای پیش آمده برای رسوب زدایی سیستم خیلی گرانتر از پیشگیری قبل از هر اتفاقی است.
رسوبزدای هیدروفلو با عملکرد فوق العادهای که از خود نشان داده است میتواند سختی آب مصرفی شما را از بین ببرد و دیگر لازم نیست نگران رسوب موجود در سیستم لولهکشی خود باشید. اگر تمایل دارید تا اطلاعات بیشتری در مورد رسوبزدای هیدروفلو و نحوه کارکرد آن بدست آورید میتوانید پستهای ما را دنبال کند یا با کارشناسان ما در واحد مشاوره و فروش هیدروفلو تماس حاصل نمایید.
منبع: https://www.hydroflow-usa.com/Hard-Water-Facts




